Síndrome del niño burbuja: así viven los niños que nacen sin sistema inmunitario
Sin un sistema inmune para defendernos de los patógenos, somos presas de todo tipo de infecciones, e incapaces de sobrevivir más allá del primer año de vida

Cuando Sarah tenía apenas 10 días, su madre Maria-Luiza Prioteasa, comenzó a notar que algo no andaba bien con su niña.
"Vomitaba mucho, no subía de peso, tenía diarrea, el pañal le irritaba la piel hasta dejarla sangrando", recuerda.
"Como soy muy delgada y no suelo comer muy sano pensé que mi leche no era lo suficientemente buena. Entonces probé alimentarla durante una semana mitad con mi leche y el resto con leche de fórmula", continúa.
Pero los intentos de esta madre de South Yorkshire, en el centro de Reino Unido, no dieron los resultados que esperaba: la bebé continuaba perdiendo peso.
Tras cinco semanas donde se monitoreó de cerca la alimentación de Sarah y varios análisis de sangre, los médicos llegaron a un diagnóstico: la pequeña padecía el síndrome de inmunodeficiencia combinada grave por deficiencia de adenosina-desaminasa (más conocida por sus siglas en inglés, ADA-SCID), un raro trastorno genético que deja a quien lo sufre sin armas para combatir cualquier clase de infección.
Enfermedad del niño burbuja
Las siglas SCID engloban a un grupo de desórdenes genéticos que afectan el desarrollo del sistema inmune.

Hay varios tipos de SCID, que varían según la proteína o el gen afectado. Pero todas sus modalidades tienen algo en común: los glóbulos blancos específicos (los linfocitos) funcionan de forma incorrecta o no están presentes, y por ello el cuerpo no cuenta con un sistema inmunológico adecuado para defenderse de virus, hongos y bacterias.
Sin tratamiento, los niños que nacen con esta condición sucumben ante infecciones oportunistas y, por lo general, no superan el año de vida.
Según le explica a BBC Mundo Claire Booth, inmunóloga pediátrica del hospital para niños Great Ormond Street, en Londres, se estima que "entre todas las formas SCID hay 1 caso cada 100 mil nacimientos en el mundo. El tipo más severo es la deficiencia de ADA, donde el paciente carece de células T, B y NK (conocidas también como asesinas naturales)".
Lee también: Consumo excesivo de paracetamol en el embarazo aumenta riesgo de autismo y TDAH
Es el trastorno que le diagnosticaron en 2016 a Sarah, y muchos años antes a David Vetter, un niño estadounidense cuya historia capturó la atención del público en los años 70, y sirvió de inspiración para la película "El chico de la burbuja de plástico", protagonizada por John Travolta.
De allí que el síndrome se conociera popularmente como "la enfermedad del niño burbuja", nombre por el que muchos lo reconocen hoy día.
En ese momento, el único tratamiento posible para el SCID-ADA era un trasplante de médula, y ante la falta de un donante compatible, Vetter vivió en una cámara de plástico esterilizada dentro de su casa, y solo pudo aventurarse fuera de ella cuando la NASA le diseñó un traje especial que le permitía moverse por el mundo exterior a la vez que permanecer aislado.
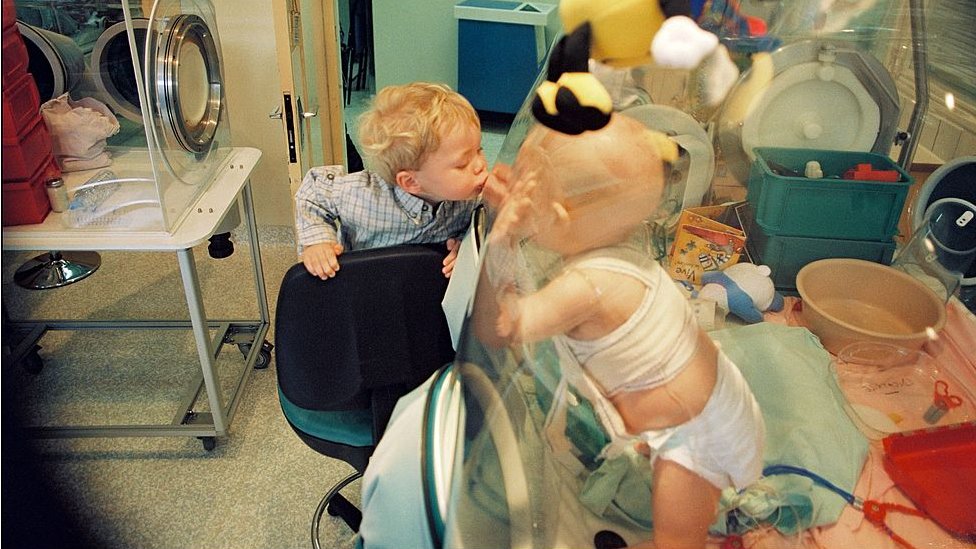
Vetter falleció en 1984 con 12 años de edad, por complicaciones derivadas de un trasplante de médula ósea que lograron hacerle con una técnica nueva en ese momento que no requería una compatibilidad al 100%.
Terapia genética, un avance revolucionario
Con los años, nuevos tratamientos fueron apareciendo: mientras se espera por un donante compatible, los pacientes son tratados con antibióticos, inyecciones de inmoglobulina -una solución de anticuerpos humanos-, y en ocasiones transfusiones de sangre.
Son soluciones temporales, costosas, y de inconveniente ejecución.
Sin embargo, una terapia genética puesta a prueba por investigadores de la Universidad de California, en Estados Unidos y del Hospital Great Ormond Street, en Reino Unido, durante un ensayo experimental, demostró que es posible reparar el sistema inmunitario de niños con SCID-ADA, sin recurrir a un trasplante.
Lee también: Virus NIPAH: Bajo la lupa de la OMS
El tratamiento consiste en sacar primero células madre que forman la sangre del paciente. Luego, en el laboratorio, mediante un vector viral llamado lentivirus, se inserta en estas célula el material genético que le falta al paciente (una versión correcta del gen ADA).
Estas células madre corregidas, una vez que se vuelven a injertar dentro del paciente, comienzan a producir un suministro aparentemente continuo de células inmunitarias sanas capaces de combatir las infecciones.

De los 50 niños tratados en ambos países, 48 volvieron a restablecer su función inmune y retomaron una vida normal, es decir, en contacto con otros niños y sin necesidad de continuar con medicación.
"Hemos visto más de un 95% de eficacia después de dos o tres años de terapia, con lo cual tenemos la confianza de que será un tratamiento de efecto duradero", le dice a BBC Mundo Booth, coautora del estudio publicado en la revista New England Journal of Medicine.
Ventajas
Durante el ensayo no se reportaron complicaciones, y la mayoría de los efectos adversos de la terapia fueron leves o moderados. Mientras que los beneficios, cuando se la compara con un trasplante de médula son muchos, explica Booth.
Por empezar, encontrar un donante compatible no es fácil, sobre todo para los pacientes que pertenecen a minorías étnicas.
Pero además, "como (en un trasplante) estás poniendo las células de otra persona en el paciente, siempre hay un riesgo de que las rechace, de que se produzca una pelea que puede afectar a muchos órganos en el cuerpo: la piel, el hígado, los intestinos, los pulmones y eso puede ser muy serio", señala la inmunóloga.
Lee también: Tratamiento con algas restaura parcialmente la visión de un hombre ciego
"También tenemos que usar quimioterapia antes del trasplante de un donante que no es pariente, para vaciar de alguna manera la médula ósea y hacer espacio para que entren las nuevas células, y luego el paciente tiene que tomar fármacos inmunodepresores por un buen tiempo para evitar un enfrentamiento entre sus células y las del donante".

"En cambio, como la terapia genética utiliza las propias células del paciente, no existe el riesgo de una lucha. Y, como no tenemos que utilizar tanta quimioterapia antes del procedimiento, esta es, en su conjunto, mucho menos tóxico", dice Booth.
Después de la terapia genética, "al sistema inmune le toma unos tres meses alcanzar un buen nivel y un poco más hasta que se recupera por completo. Por ello el paciente debe tomar medicinas preventivas por los primeros seis o doce meses. Luego pueden dejar la mayoría de ellas y empezar a socializar y llevar una vida normal".
"Para las familias esto es algo increíble", comenta la experta.
Una "niña normal"
Sarah, la niña de South Yorkshire que hoy tiene 5 años, es una de las pacientes a las que el ensayo le cambió la vida.
Atrás quedaron los días en que Sarah no podía siquiera darle un beso a su hija o dormir con ella.
"Si me tocaba la cara, por ejemplo, tenía que ir a lavarme las manos hasta el codo por dos o tres minutos. A veces me sangraban por eso. Si el chupete se le caía al suelo, tenía que esterilizarlo antes de dárselo otra vez", dice.
"Yo me quedaba con ella casi todo el tiempo en la habitación, y me cambiaba dos veces al día y también limpiaba la casa dos veces al día por la necesidad de protegerla", cuenta.
Lee también: ¿El nuevo etiquetado ha reducido el consumo de la comida chatarra?
"Hoy día, Sarah va al parque y no tenemos que limpiar cada vez el sitio donde se sienta, va a la escuela, a danza, al club de vacaciones... es una niña normal, tiene muchos amigos, e incluso ahora podemos tener una mascota en la casa".
"Su vida cambió por completo. Y yo estoy feliz de que todo haya pasado cuando era tan pequeña y no podía darse cuenta de lo que estaba pasando".
Recuerda que puedes recibir notificaciones de BBC News Mundo. Descarga la nueva versión de nuestra app y actívalas para no perderte nuestro mejor contenido.
https://www.youtube.com/watch?v=2f3bWviThuQ
fjb